Contenido
Infecciones del torrente sanguíneo
Las infecciones del torrente sanguíneo son producidas mayormente cuando se insertan dispositivos como: CVP catéter venoso periférico o CVC catéter venoso central, especialmente los colocados en las unidades de cuidados intensivos (UCI).
El uso de un catéter venoso central CVC es proporcionar un acceso directo en una vena de grueso calibre para hacer grandes aportes parenterales, mediciones hemodinámicas o cubrir situaciones de emergencia. Cuando un paciente se encuentra con un CVC, se debe prestar suma atención a signos de infección por dicho catéter.
Cultivo de catéter
Uso preferente de la prueba
- Diagnóstico de sepsis asociada a catéter venoso central.
Preparación e instrucciones al paciente
Antes de la toma de muestra, se deben considerar las siguientes recomendaciones:
- Indicación de remoción del catéter: bacteriemia y/o sepsis persistente por más de 48 a 72 horas, presencia de complicaciones locales evidentes, presencia de complicaciones metastásicas (endocarditis infecciosa, embolia pulmonar o periférica), aislamiento de microorganismos difíciles de erradicar (levaduras, S. aureus, Pseudomonas spp), o según criterio médico clínico.
- Cada vez que se retire un catéter venoso central con sospecha clínica de infección sistémica asociada a este dispositivo, se deben obtener hemocultivos por venopunción y enviar el extremo distal del catéter venoso central a estudio microbiológico.
- Se indica sólo frente a sospecha de bacteriemia asociada a catéter venoso central, siempre en conjunto con un set de hemocultivos periféricos.
- Se indica cultivo semicuantitativo de punta de catéter venoso central.
- Se confirma una bacteriemia asociada a catéter venoso central si se recupera el mismo microorganismo aislado en hemocultivo periférico y en la punta del catéter con un recuento igual o mayor a 15 UFC.
Procedimiento
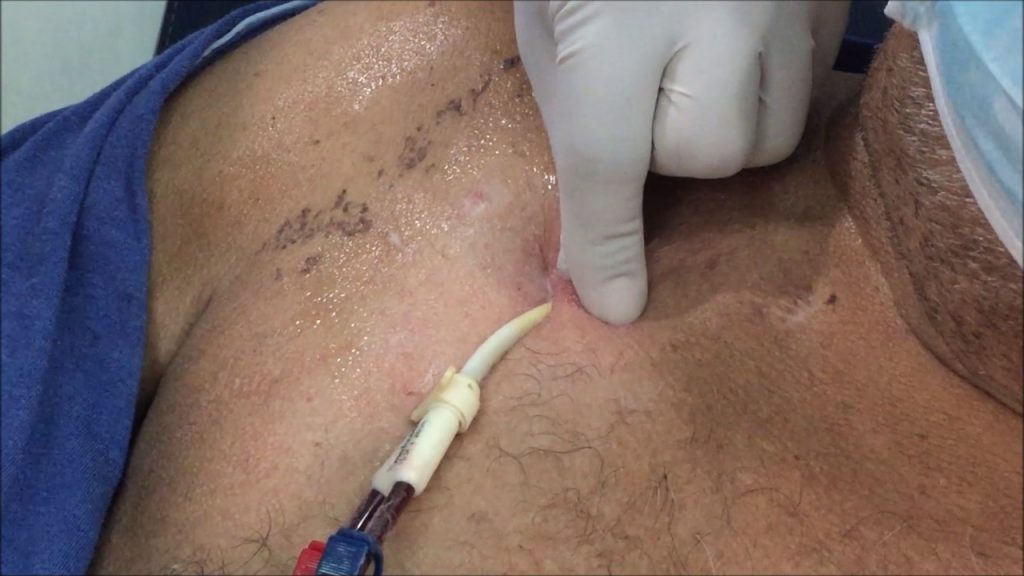
- Desinfectar piel del sitio de inserción del catéter venoso central con alcohol.
- Retirar el catéter venoso central mediante técnica aséptica.
- Cortar e introducir en tubo estéril 5 cm. del extremo distal del catéter venoso central.
- Técnica recomendada solo para puntas de catéter asociado a torrente sanguíneo.
Información general
- Rangos de referencia: Negativo
– Informe negativo
– Colonización con recuento menor a 15 UFC
– Informe positivo con recuento mayor o igual de 15 UFC - Método: Cultivo corriente / Técnica de Maki
- Tipo de muestra: Punta de Catéter Venoso Central
- Tipo de tubo: Tubo estéril
- Volumen mínimo necesario: 5 centímetros del extremo distal del catéter venoso central.
- Condiciones de transporte: Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de media hora desde la toma de muestra a temperatura ambiente.
Hemocultivo
Uso preferente de la prueba
- Diagnóstico de agente etiológico causante de bacteriemias/fungemias.
Preparación e instrucciones al paciente
- Las muestras tienen que tomarse idealmente antes de la administración de antimicrobianos y preferentemente, no tomarlas inmediatamente después de cirugía abdominal o de la ingestión de alimentos.
- Se deben tomar al menos 2 frascos de hemocultivo, extraídos de sitios de punción diferentes (no de catéter).
- Debe ser siempre la primera muestra a tomar si existe indicación de otros exámenes.
- Si se sospecha endocarditis bacteriana se debe obtener un set de al menos 2 frascos de hemocultivo.
- Si están negativos a las 24 horas, tomar un segundo set de hemocultivos.
- Si se sospecha infección por anaerobios se debe reemplazar uno de los frascos de hemocultivo aerobio por uno anaerobio (solicitado al laboratorio y según disponibilidad).
- El estudio de hemocultivo de hongos o microorganismos del grupo HACEK no requiere condiciones diferentes de toma de muestra ni frascos distintos, pero debe consignarse en el formulario de solicitud de examen que la muestra requiere cultivo para hongos o búsqueda de HACEK.
- Si se requiere establecer bacteriemia asociada a catéter venoso central revise las prestaciones “Catéter, Cultivo de” o “Hemocultivos Cuantitativos” o “Hemocultivos, Tiempo Diferencial de”.
Procedimiento
- La extracción debe ser realizada por personal entrenado.
- Reunir el material, identificar los frascos con nombre y apellido del paciente, lavarse las manos e informar al paciente del procedimiento.
- Elegir el sitio de punción y preparar la piel.
- La limpieza debe ser con agua y jabón.
- Antisepsia con alcohol de 70º.
- Realizar la punción y extraer la muestra, inocular en los frascos previa desinfección de la goma con etanol 70º.
- Repetir los pasos para el 2º frasco periférico (en sitio de punción diferente).
- Eliminar material corto-punzante según norma, retirar los guantes y lavar las manos.
Información general
- Rangos de referencia: Negativo
- Método: Cultivo de sangre en medio líquido automatizado BD BACTEC.
- Tipo de muestra: Sangre por punción venosa periférica.
- Tipo de tubo: Frascos de hemocultivos comerciales.
- Volumen mínimo necesario: – Adultos y niños de más de 15 kilos: 8 a 10 mL de sangre en cada frasco.- Niños entre 1 y 6 años: 1 a 5 mL de sangre en cada botella.- Neonatos: mínimo 1 mL de sangre por cada botella.
- Condiciones de transporte: Los frascos se deben transportar en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 1 hora desde la toma de muestra


Hemocultivos cuantitativos
Uso preferente de la prueba
- Diagnóstico de sepsis asociada a catéter venoso central, para determinar si es necesario retirar el catéter venoso central.
Preparación e instrucciones al paciente
- Se indica en caso de sospecha de sepsis asociada a catéter venoso central cuando no es posible retirar el catéter venoso central.
- Esta técnica compara la concentración bacteriana presente en la sangre obtenida por una punción periférica y una muestra obtenida a través del catéter venoso central.
- Permite descartar o confirmar que el catéter venoso central sea el foco de la sepsis, si no lo es, se debe mantener el catéter instalado.
- El estudio consta de dos muestras:
Hemocultivo periférico: Tomar hemocultivo periférico siguiendo las mismas indicaciones que para hemocultivos cualitativos, pero puncionar con jeringa con baño de heparina estéril.
– En caso de pacientes adultos y niños mayores aspirar 1,5 a 3 mL de sangre.
– Para pacientes de neonatología aspirar mínimo 1 mL de sangre.
– Agregar al frasco la indicación “Sangre periférica”, eliminar la aguja y poner tapa estéril.
Hemocultivo por catéter: Tomar hemocultivos a través del catéter.
– Si se trata de niños y neonatos aspirar con jeringa sin heparina 0,2 mL de sangre y eliminar.
– Si se trata de pacientes adultos aspirar 0,5 mL de sangre y eliminar. - Luego con jeringa heparinizada estéril aspirar 1,5 a 3 mL en adultos y niños mayores y mínimo 1 mL de sangre en neonatos.
- Rotular “Sangre catéter”, además indicar el lumen si corresponde.
- Eliminar aguja y poner tapa estéril.
- Tomar muestras de cada uno de los lúmenes o el más utilizado (el de mayor riesgo).
Información general
- Rangos de referencia: Negativo
- Método: Cultivo corriente cuantitativo
- Tipo de muestra: Sangre venosa periférica y sangre de catéter.
- Tipo de tubo: Jeringa heparinizada con tapón estéril.
- Volumen mínimo necesario: Según lo indicado en la preparación e indicaciones al paciente.
- Condiciones del transporte: Las jeringas se deben transportar en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra
- Tiempo de transporte: Antes de 1 hora desde la toma de muestra
Tiempo diferencial de hemocultivos
Uso preferente de la prueba
- Ayuda en el diagnóstico de infección del torrente sanguíneo asociada a catéter vascular central (ITS-CVC).
- Esta metodología consiste en obtener hemocultivos pareados, central y periférico, comparando el tiempo diferencial de positividad de los cultivos cualitativos de la sangre obtenida a través del catéter y por venopunción, utilizando sistemas de hemocultivos automatizados.
- Si hay una diferencia mayor a 2 horas entre el momento en que el hemocultivo central y el hemocultivo periférico se hacen positivos, es indicativo que el foco de la sepsis es el catéter central, con el mismo microorganismo y antibiograma.
Preparación e instrucciones al paciente
Antes de la toma de muestra, se debe tener en cuenta las siguientes recomendaciones:
- Las muestras tienen que tomarse idealmente antes de la administración de antimicrobianos y preferentemente, no tomarlas inmediatamente después de cirugía abdominal o de la ingestión de alimentos.
- Se debe tomar 1 frasco de hemocultivo por cada lumen del catéter, más sangre periférica en al menos 2 frascos de hemocultivo de dos venopunciones diferentes y en iguales volúmenes.
- Los frascos deben ser recolectados en un intervalo no mayor a 30 minutos y respetando los volúmenes de llenado del tipo de frasco utilizado.
- Identificar cada frasco según lugar anatómico, por ej: periférico 1, periférico 2, rama arterial, rama venosa, rama proximal, rama medial, rama distal, etc.
Procedimiento
- La extracción debe ser realizada por personal entrenado.
- Reunir el material, identificar los frascos con nombre y apellido del paciente, lavarse las manos e informar al paciente del procedimiento.
- Para la toma periférica proceder igual que en la prestación “Hemocultivo”: elegir el sitio de punción y preparar la piel.
- La limpieza debe ser con agua y jabón.
- Antisepsia con alcohol de 70º.
- Realizar la punción y extraer la muestra, inocular en el frasco previa desinfección de la goma con etanol 70º.
- Consignar el volumen inoculado.
- Repetir los pasos para el 2º frasco periférico (en sitio de punción diferente) inoculando el mismo volumen que en el 1º frasco.
- Para la toma de sangre de catéter, desinfectar previamente el(los) puerto(s) del lumen del catéter con etanol 70º, dejar secar, extraer el volumen requerido e inocular el(los) frascos con igual volumen a los frascos periféricos.
- Eliminar material corto-punzante según norma, retirar los guantes y lavar las manos.
Información general
- Rangos de referencia: Negativo
- Método: Cultivo de sangre en medio líquido automatizado BD BACTEC.
- Tipo de muestra: Sangre por punción venosa periférica y catéter.
- Tipo de tubo: Frascos de hemocultivos comerciales.
- Volumen mínimo necesario: Adultos y niños de más de 15 kilos: 8 a 10 mL de sangre en cada frasco. – Niños entre 1 y 6 años: 1 a 5 mL de sangre en cada botella.- Neonatos: mínimo 1 mL de sangre por cada botella.
- Condiciones de transporte: Los frascos se deben transportar en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 1 hora desde la toma de muestra.

Información del autor
- Manual de toma de muestra. Unidad de Lab.Clinico-Complejo asistencial Dr. Sotero del Rio. Chile. Año 2018
- Lorena Plazas. Lic. en enfermeria. Trabajo propio.
- https://www.revista-portalesmedicos.com/revista-medica/protocolo-extraccion hemocultivos-oncologia-pediatrica/Imagen hemocultivo frasco
- https://odont.info/toma-de-muestras-para-diagnostico-microbiologico.html. Imagen
Última actualización: [22/10/2022]
Claritromicina – Cuidados de enfermería
Meropenem – Cuidados de enfermería

10 Servicios de enfermería

Libros auxiliar de enfermeria

Trastorno de Oposición Desafiante en niños ¿Cómo identificarlo?

Diferencia entre Nutrición Comunitaria y Educación Alimentaria
Escala Canadiense: Utilidad, Interpretación y Aplicaciones Clínicas

Raciones para Dieta Hipocalórica

Que es la alimentación hedónica


