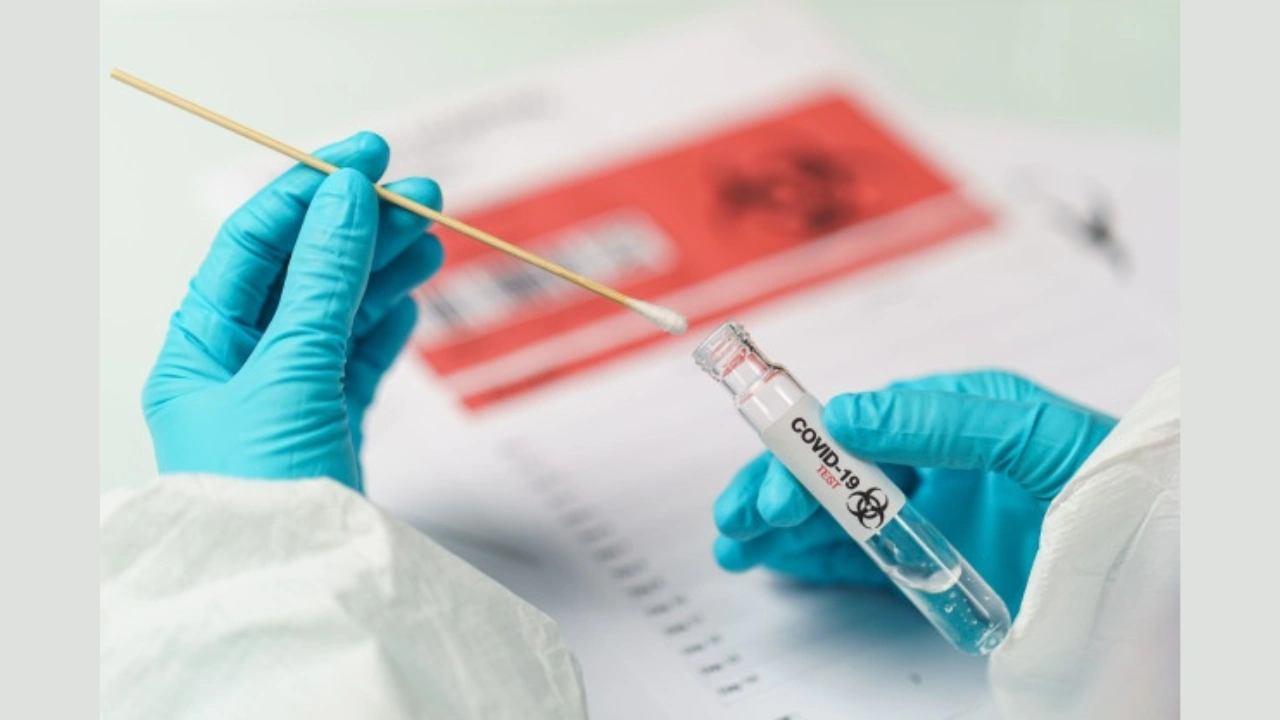
Hisopado para SARG-CoV-2 y muestras laboratorio Vías Aéreas
Hisopado para genoma de SARG-CoV-2 (COVID-19)
Las muestras deben ser recolectadas por personal capacitado y teniendo en cuenta todas las instrucciones de bioseguridad y el equipo de protección personal apropiado para virus respiratorios.
Tipos de muestras
Las muestras recomendadas para la detección de genoma de SARS-CoV-2 son:
- Esputo: el contenido deberá colocarse en un tubo plástico, estéril, con tapa a rosca y cierre hermético. Procedimiento se detalla en “Cultivo de expectoración espontánea”.
- Lavado broncoalveolar o aspirado traqueal (cuando sea posible): el contenido se introducirá en un tubo plástico, estéril, con tapa a rosca y cierre hermético.
- Hisopado nasofaríngeo combinado con un hisopado orofaríngeo.
- Aspirado nasofaríngeo: para niños menores de 5 años o cuando no sea posible realizar un hisopado. Se deberá utilizar sonda nasogástrica (tipo K 33 o SK 92). Luego de la aspiración colocar las sondas, sin cortar ni anudar, en frasco estéril, con tapa a rosca y cierre hermético. Ver procedimiento de colocación de sonda nasogástrica.
Medidas de bioseguridad para la extracción de todas las muestras
- Lavado de manos
- Camisolín hidrorrepelente
- Barbijo N95
- Gafas o antiparras
- Guantes no estériles o estériles según corresponda a la práctica
- Máscara facial
Hisopado Nasofaríngeo
Uso preferente de la prueba
- Detección de genoma de SARG-CoV-2.
Preparación e instrucciones al paciente
- Poner la cabeza del paciente en un ángulo de aproximadamente 70º.
- Introducir el hisopo de dacrón en ambas fosas nasales, deslizándolo por la mucosa del piso de la fosa nasal hasta tocar la pared posterior de la faringe; frotar la faringe haciendo girar el hisopo para obtener una buena cantidad de células epiteliales.
- Colocar el hisopo en su correspondiente medio de transporte.
- Realizar con otro hisopo toma de muestra de fauces.
- Los hisopos a utilizar deben ser de torunda de nylon, dacrón o viscosa con manguito plástico. Los mismos se deberán sumergir en 2 ml de medio de transporte para virus o, en su defecto, en 4 gotas de solución salina o agua destilada de uso parenteral (estéril).
Información general
- Rangos de referencia: NEGATIVO.
- Método: RT-PCR Real time, detecta material genético. NAAT (Prueba de amplificación de ácido nucleico).
- Tipo de muestra: Secreción nasofaríngea.
- Tipo de tubo: Plástico, estéril, con tapa a rosca y cierre hermético.
- Volumen mínimo necesario: Hisopo con 100 μL de una muestra nasofaríngea.
- Condiciones de transporte: El transporte de muestras dentro de la institución debe realizarse en contenedores secundarios que no hayan estado en contacto con el ambiente del paciente (por ejemplo, en doble bolsa plástica cerrada).
- Tiempo de transporte: Las muestras deben mantenerse refrigeradas (4-8°C) y deben ser enviadas al laboratorio de referencia tan pronto como sea posible.
- Ficha de notificación: La ficha de notificación no debe usarse para envolver las muestras. Debe enviarse dentro de una bolsa plástica adherida sobre el recipiente externo.
- Notificación: Todo caso sospechoso constituye un evento de notificación obligatoria en el marco de la Ley 15465 y, por tanto, debe ser notificado en forma inmediata y completa al Sistema Nacional de Vigilancia de la Salud (SNVS 2.0), dentro del Grupo de Eventos: Infecciones respiratorias agudas (IRAS), según el Evento que corresponda:
♦ Caso sospechoso COVID-19
♦ Contacto de caso COVID-19
Embalaje de muestras para diagnóstico COVID-19
Estas recomendaciones están tomadas de la Guía sobre la reglamentación relativa al transporte de sustancias infecciosas 2019–2020. OMS
Las sustancias infecciosas sub-clasificadas en categoría B (UN 3373) deben ser envasadas de acuerdo con la instrucción P650 de la Reglamentación Modelo de las Naciones Unidas para considerarse seguras y conformes para todos los modos de transporte.
El sistema de embalaje con triple envase es el obligatorio para el transporte de sustancias infecciosas. Si no se cuenta con embalaje comercial, se debe realizar una adaptación con elementos existentes en el laboratorio.
Sistema básico de embalaje/envasado triple
Como su nombre lo indica, es un sistema de embalaje/envasado triple utilizado para contener una sustancia infecciosa y el recipiente debe constar de tres capas:
Primario
El cual contiene la sustancia infecciosa, que debe ser estanco, a prueba de fugas y estar debidamente etiquetado. Debe ir envuelto en material absorbente suficiente para absorber todo el líquido en caso de rotura o fuga.
Secundario
El recipiente primario se introduce en un segundo embalaje/envase protector estanco y a prueba de fugas. Pueden colocarse varios recipientes primarios en un solo embalaje/envase secundario, siempre que contengan sustancias infecciosas de la misma clase. Si se envían varias muestras en un mismo contenedor secundario, se recomienda envolver las muestras de cada paciente en bolsas plásticas, de manera de impedir el contacto entre las muestras de los pacientes individuales.
Terciario/externo
El embalaje/envase externo protege el embalaje/envase secundario de los daños físicos durante el transporte. Por lo tanto, esta capa debe tener una resistencia adecuada al peso, tamaño y composición de los paquetes interiores, a fin de garantizar la protección de los mismos. La dimensión exterior mínima debe ser de al menos 100 mm. Este recipiente se rotula con la información de remitente y destinatario, indicando además que se trata de muestras para diagnóstico de COVID-19. NO SE DEBEN INCLUIR MUESTRAS PARA OTRAS PATOLOGÍAS.
Aspirado nasofaríngeo
Uso preferente de la prueba
- Diagnóstico de Bordetella pertussis en pacientes con sospecha de coqueluche.
Preparación e instrucciones al paciente
- La extracción debe ser realizada por personal entrenado.
- Reunir el material, lavarse las manos e informar al paciente del procedimiento.
- Eliminar la secreción nasal visible de las fosas nasales antes de iniciar el procedimiento.
- Utilizar mascarilla y guantes estériles.
- Usar como referencia la distancia entre la aleta nasal y el lóbulo de la oreja para lograr aspirar exactamente la nasofaringe (medir con la sonda).
- Humedecer la sonda con suero fisiológico estéril; traccionando levemente la nariz hacia arriba, introducir la sonda por una fosa nasal en forma horizontal, después de pasar los cornetes dirigirla hacia abajo y cuando el paciente exprese el acto reflejo de rechazo aspirar en forma intermitente, retirar la sonda e introducirla en el tubo con 8 mL de suero fisiológico estéril aspirar todo el contenido.
- Vaciar el aspirado al tubo de vidrio, etiquetar el tubo con el nombre del paciente y enviar al laboratorio.
- Obtención de la Muestra: Idealmente la muestra debe ser obtenida antes del inicio de la antibioterapia (1º o 2º día de hospitalización).
- La muestra de elección es el Aspirado Nasofaríngeo en todos los grupos de edad.
- Sólo en el caso de no obtener esta muestra, se recomienda la secreción nasofaríngea (tomada con tórula especial) en niños mayores y adultos.
- En el caso de pacientes intubados, se recomienda el aspirado bronquial.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Inmunofluorescencia directa.
- Tipo de muestra: Secreción nasofaríngea.
- Tipo de tubo: Tubo de vidrio estéril con 8 mL de suero fisiológico, entregado por el laboratorio.
- Volumen mínimo necesario: 8 mL.
- Condiciones de transporte: Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a 4 ºC de temperatura (utilizar unidades refrigerantes congeladas). El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 2 horas desde la toma de muestra.
Cultivo de expectoración espontánea
Uso preferente de la prueba
- Detección de microorganismos causantes de infecciones respiratorias bajas.
Preparación e instrucciones al paciente
- Las muestras deben ser tomadas idealmente a primera hora de la mañana, en ayunas.
- La obtención de la muestra debe ser realizada por personal entrenado.
- Reunir el material, lavarse las manos e informar al paciente del procedimiento.
- El personal que asiste al paciente durante la toma de muestra debe procurar que la muestra sea expectoración y no saliva.
- Solicitar al paciente que se lave y cepille los dientes con agua y realice varios lavados continuos solamente con agua o suero fisiológico para limpiar la cavidad oral.
- Luego indicar al paciente que inspire profundamente y tosa depositando directamente la secreción en el pomo estéril.
- Si se sospecha tuberculosis se deben tomar 2 muestras (una cada día) en días consecutivos y se deben enviar en un pomo estéril protegido de la luz, junto al formulario de solicitud de examen que indique la sospecha clínica.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente / Tinción de Gram.
- Tipo de muestra: Expectoración.
- Tipo de tubo: Pomo estéril, proteger de la luz en caso de sospecha de tuberculosis.
- Volumen mínimo necesario: 1 muestra y 2 muestras en caso de sospecha de tuberculosis.
- Condiciones de transporte: Los pomos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Media hora a temperatura ambiente desde la toma de muestra.
Cultivo de punción timpánica
Uso preferente de la prueba
- Diagnosticar microorganismos productores de otitis media.
Preparación e instrucciones al paciente
- Se requiere aviso previo a la toma de muestra al Laboratorio para ser procesado al momento que se reciba la muestra.
- La muestra debe ser extraída por el profesional especialista (Otorrinolaringólogo).
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente / Tinción de Gram.
- Tipo de muestra: Aspirado de secreción oído medio.
- Tipo de tubo: Tubo de cultivo estéril sin aditivos.
- Volumen mínimo necesario: La totalidad de la muestra extraída en la punción timpánica.
- Condiciones de transporte: Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 30 minutos desde la toma de muestra a temperatura ambiente.
Cultivo de secreción faríngea
Uso preferente de la prueba
- Diagnosticar la presencia de Streptococcus pyogenes (Streptococcus beta hemolítico Grupo A) y otros Streptococcus beta hemolíticos en faringe.
Preparación e instrucciones al paciente
- La extracción debe ser realizada por personal entrenado.
- Reunir el material, lavarse las manos e informar al paciente del procedimiento.
- Deprimir la lengua con bajalenguas, introducir la tórula cuidando de no tocar la mucosa oral ni la lengua, frotar las amígdalas y pared posterior de la faringe.
- Introducir la tórula en medio de transporte Stuart y enviar inmediatamente al laboratorio a temperatura ambiente.
- Si se sospecha de Difteria o Angina de Vincent, comunicarse con el laboratorio antes de tomar la muestra para asegurarse de que estén disponibles los insumos necesarios para la búsqueda dirigida.
- Si se sospecha de Difteria, tomar la muestra del borde de la membrana evitando desprenderla.
- Introducir la tórula al medio de transporte Stuart y enviar inmediatamente al laboratorio.
- Si se sospecha de Angina de Vincent tomar secreción faríngea según las indicaciones, solicitar tinción de Gram e indicar claramente la sospecha en la solicitud de examen.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente.
- Tipo de muestra: Secreción faríngea.
- Tipo de tubo: Medio de transporte Stuart con una tórula.
- Volumen mínimo necesario: 1 medio de transporte Stuart con una tórula
- Condiciones de transporte: El medio de transporte se debe transportar tapado, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 2 horas desde la toma de muestra a temperatura ambiente.
Cultivo de secreción nasal
Uso preferente de la prueba
- Diagnóstico de portación nasal de Staphylococcus aureus.
- El cultivo no es apto para estudio de patología del tracto superior.
Preparación e instrucciones al paciente
- La toma de muestra debe ser realizada por personal entrenado.
- Reunir el material, lavarse las manos e informar al paciente del procedimiento.
- Introducir una tórula estéril humedecida en suero fisiológico estéril a través de los orificios nasales (vestíbulo nasal) unos dos centímetros y frotar firmemente por la mucosa nasal anterior.
- Colocar en medio de transporte Stuart y enviar de inmediato al Laboratorio.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente de portación.
- Tipo de muestra: Secreción nasal.
- Tipo de tubo: Medio de transporte Stuart con una tórula.
- Volumen mínimo necesario: 1 medio de transporte Stuart con una tórula.
- Condiciones de transporte: El medio de transporte se debe transportar tapado, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 1 hora desde la toma de muestra a temperatura ambiente.
Cultivo de secreción ótica
Uso preferente de la prueba
- Diagnosticar la presencia de microorganismos causantes de otitis externa.
Preparación e instrucciones al paciente
- La toma de muestra debe ser realizada por personal entrenado.
- Reunir el material, lavarse las manos e informar al paciente del procedimiento.
- Limpiar el pabellón auricular con suero fisiológico estéril, a continuación con una tórula estéril recoger la secreción presente en el conducto auditivo, introducir la tórula en medio de transporte Stuart, repetir el procedimiento anterior colocando la tórula en el mismo medio de transporte para hacer tinción de Gram.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente / Tinción de Gram.
- Tipo de muestra: Secreción ótica.
- Tipo de tubo: Medio de transporte Stuart con 2 tórulas.
- Volumen mínimo necesario: 1 medio de transporte Stuart con 2 tórulas.
- Condiciones de transporte: El medio de transporte se debe transportar tapado, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 1 hora desde la toma de muestra a temperatura ambiente.
Cultivo de secreción sinusal
Uso preferente de la prueba
- Diagnosticar la presencia de Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, microorganismos anaerobios y hongos, causantes de sinusitis aguda o crónica.
Preparación e instrucciones al paciente
- La toma de muestra debe ser realizada sólo por el médico especialista.
- Si se sospecha de difteria, comunicar al laboratorio la sospecha diagnóstica antes de tomar la muestra.
- Tomar la muestra del borde de la membrana evitando desprenderla.
- Introducir la tórula al tubo estéril y enviar inmediatamente al laboratorio.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente / Tinción de Gram.
- Tipo de muestra: Secreción sinusal.
- Tipo de tubo: Jeringa estéril.
- Volumen mínimo necesario: Totalidad del volumen obtenido en la punción.
- Condiciones de transporte: La muestra se debe transportar tapada, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames a temperatura ambiente. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Antes de 2 horas desde la toma de muestra a temperatura ambiente.
Cultivo de aspirado traqueal
Uso preferente de la prueba
- Diagnóstico de microorganismos causantes de infección respiratoria baja en pacientes hospitalizados.
Preparación e instrucciones al paciente
- La extracción debe ser realizada por personal entrenado.
- Utilizando técnica aséptica introducir la sonda estéril por el tubo endotraqueal hasta encontrar resistencia, aspirar secreciones y depositarlas directamente en un frasco estéril.
- No usar suero fisiológico para facilitar la aspiración de secreciones, ya que esto diluye la muestra e invalida la cuantificación de microorganismos.
- Para el estudio etiológico de neumonía asociada a ventilación mecánica (más de 48 horas de conectado al equipo de ventilación) solicitar explícitamente en el formulario de solicitud de examen “cultivo cuantitativo” del aspirado endotraqueal.
Información general
- Rangos de referencia: NEGATIVO.
- Método: Cultivo corriente cualitativo y cuantitativo / Tinción de Gram.
- Tipo de muestra: Aspirado o secreción traqueal.
- Tipo de tubo: Tubo cónico de aspiración plástico y estéril.
- Volumen mínimo necesario: 1 a 2 mL de secreción traqueal.
- Condiciones de transporte: El tubo se debe transportar tapado, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames. El formulario de solicitud de examen no debe estar en contacto con la muestra.
- Tiempo de transporte: Media hora a temperatura ambiente desde la toma de muestra.
Información del autor
- Manual de toma de muestra. Unidad de Lab.Clinico-Complejo asistencial Dr. Sotero del Rio. Chile. Año 2018
- Bioq. Paterniti Alejandra, 2020, Red de Laboratorios-Dirección Provincial de Organización de Establecimientos, Ministerio de Salud, Provincia de Neuquén, Argentina. pp: 1/14. Disponible en: https://www.saludneuquen.gob.ar/wp-content/uploads/2020/04/MSaludNQN-Covid-19-Recomendaciones-toma-muestras-diagn%C3%B3stico-COVID-19.pdf
- Lorena Plazas. Lic. en enfermeria. Trabajo propio.
- https://aps.isss.gob.sv/familia/salud.Imagen 1
- https://campus.usal.es/~micromed/Practicas_odontologia/unidades/labv/ LabMicro/toma_muestras.html. Imagen 2
Última actualización: [20/10/2024]