Tipos y Grados de Hipertensión Arterial
Hipertensión Arterial
La hipertensión arterial (HTA) es uno de los principales factores de riesgo cardiovascular y una de las enfermedades crónicas más prevalentes en la población mundial. Su diagnóstico temprano y un tratamiento adecuado pueden prevenir complicaciones como infartos, insuficiencia renal y accidentes cerebrovasculares.
La Organización Mundial de la Salud (OMS) ha establecido diferentes etapas de la hipertensión según el grado de daño orgánico producido. Además, ha definido estrategias para la evaluación, diagnóstico y tratamiento de esta enfermedad, que incluyen medidas generales y farmacológicas.
En este artículo, exploraremos en detalle los criterios de la OMS para el manejo de la hipertensión arterial, abordando la evaluación del paciente, las pruebas diagnósticas y los enfoques terapéuticos más efectivos.
Hipertensión Arterial: Clasificación y Evaluación del Paciente
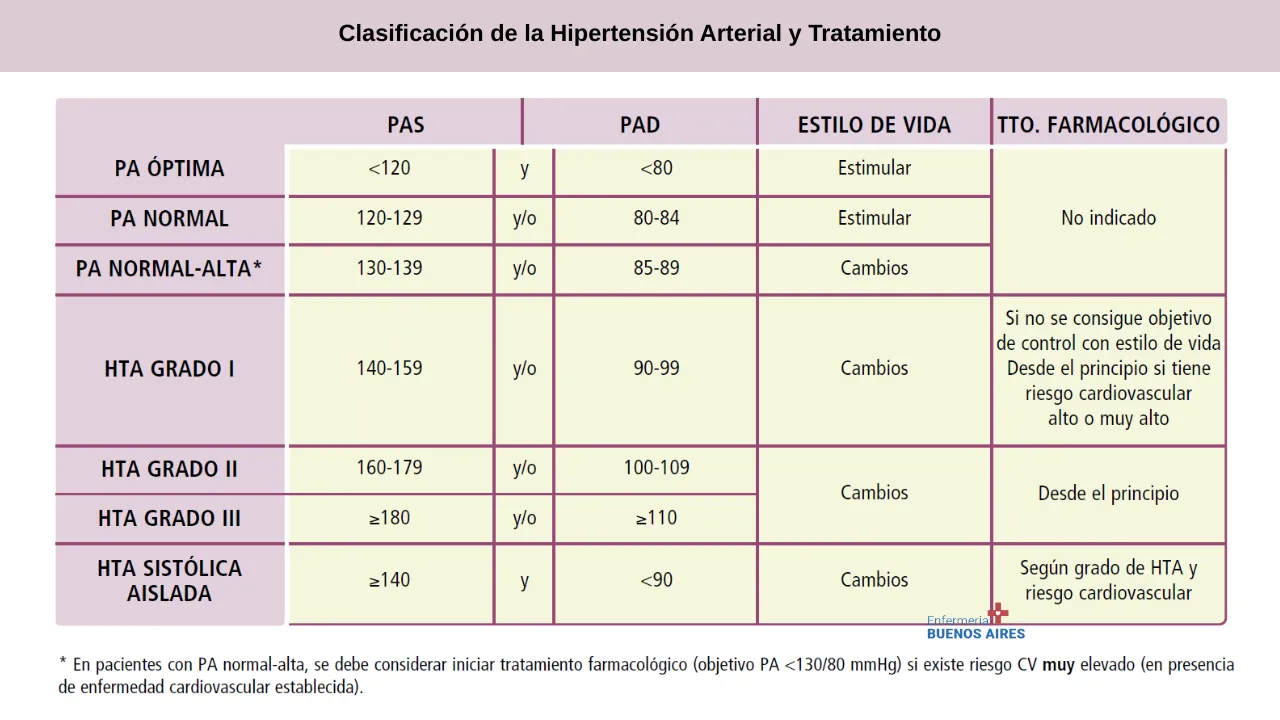
Etapas o Grados de la Hipertensión Arterial Según la OMS
La hipertensión arterial se clasifica según el grado de daño orgánico que produce en el paciente. La OMS la divide en:
-
Hipertensión grado 1: Presión arterial sistólica entre 140-159 mmHg o diastólica entre 90-99 mmHg.
-
Hipertensión grado 2: Presión arterial sistólica entre 160-179 mmHg o diastólica entre 100-109 mmHg.
-
Hipertensión grado 3: Presión arterial sistólica ≥180 mmHg o diastólica ≥110 mmHg.
Cuanto mayor sea el grado de hipertensión, mayor será el riesgo de complicaciones cardiovasculares y orgánicas.
Evaluación Clínica del Paciente Hipertenso
El proceso de evaluación de un paciente con hipertensión tiene tres objetivos principales:
-
Identificar el estilo de vida y factores de riesgo cardiovascular que puedan afectar el pronóstico y guiar el tratamiento.
-
Detectar causas secundarias de hipertensión, como enfermedades renales o endocrinas.
-
Determinar la presencia de daño en órganos diana, como corazón, riñones o cerebro.
Exploración Física y Pruebas Complementarias
La evaluación clínica debe incluir:
-
Índice de masa corporal (IMC) y circunferencia abdominal.
-
Exploración neurológica y evaluación cognitiva.
-
Palpación de pulsos carotídeos y periféricos para detectar alteraciones vasculares.
-
Auscultación cardíaca y carotídea, buscando soplos indicativos de estenosis arterial.
-
Pruebas de laboratorio: hemoglobina, creatinina, glucosa, perfil lipídico, ácido úrico y función hepática.
-
Electrocardiograma (ECG) para identificar signos de hipertrofia ventricular o arritmias.
-
Ecocardiograma, eco-doppler renal o fondo de ojo, según el estado del paciente.
Tratamiento de la Hipertensión Arterial
Objetivos Terapéuticos
El objetivo principal del tratamiento antihipertensivo es alcanzar una presión arterial <140/90 mmHg. Sin embargo, si el paciente tolera bien el tratamiento, se puede intentar reducir aún más la presión a <130/80 mmHg.
Los rangos recomendados según la edad son:
-
Pacientes menores de 65 años: Presión sistólica entre 120-129 mmHg.
-
Pacientes mayores de 65 años: Presión sistólica entre 130-139 mmHg.
Medidas Generales para el Control de la Hipertensión
Antes de iniciar un tratamiento farmacológico, es fundamental realizar cambios en el estilo de vida:
- Reducir el consumo de sal a menos de 5 gramos diarios.
- Mantener un peso saludable mediante dieta equilibrada y ejercicio.
- Evitar el tabaco y el alcohol, ya que agravan la hipertensión.
- Aumentar el consumo de potasio, presente en frutas y verduras.
- Practicar ejercicio físico regularmente, al menos 30 minutos al día.
Tratamiento Farmacológico
La indicación de fármacos depende del grado de hipertensión y del riesgo cardiovascular global del paciente.
- Hipertensión grado I con riesgo bajo-intermedio: Se recomienda modificar el estilo de vida antes de iniciar fármacos. Si en 3-6 meses no se logran los objetivos, se inicia tratamiento.
- Hipertensión grado II-III o con alto riesgo cardiovascular: Se inicia tratamiento farmacológico desde el principio, junto con cambios en el estilo de vida.
Fármacos de Primera Línea
Los fármacos más utilizados incluyen:
-
IECA o ARA-II (Inhibidores de la enzima convertidora de angiotensina o antagonistas del receptor de angiotensina II).
-
Diuréticos tiazídicos.
Estrategia recomendada: Se prefiere una combinación fija de dos fármacos en una sola pastilla para mejorar la adherencia.
Si la presión arterial no se controla con dos fármacos, se añade un tercer fármaco (IECA/ARA-II + calcioantagonista + diurético tiazídico).
Tipos de Hipertensión Arterial
Hipertensión Arterial Resistente
Si un paciente no responde a un tratamiento con tres fármacos en dosis adecuadas, se sospecha hipertensión resistente.
Causas frecuentes:
-
Mala adherencia al tratamiento.
-
Síndrome de apnea del sueño.
-
Enfermedad renal o endocrina subyacente.
Tratamiento adicional: Se puede añadir espironolactona, betabloqueantes o alfabloqueantes.
En casos de hipertensión resistente grave, se consideran opciones como la radioablación de los nervios simpáticos renales.
Hipertensión Arterial en el Paciente Anciano
La hipertensión es más frecuente en adultos mayores de 60 años. En estos pacientes, la presión arterial sistólica es el mejor predictor de riesgo cardiovascular.
Tratamiento en mayores de 80 años: Se recomienda iniciar con un solo fármaco y ajustar progresivamente, evitando la hipotensión ortostática.
Meta de presión arterial en ancianos: PAS entre 130-139 mmHg en lugar de 120-129 mmHg en adultos más jóvenes.
Hipertensión renovascular
Existen dos causas fundamentales de HTA renovascular: la displasia fibromuscular y la estenosis ateromatosa de la arteria renal. Cada una de ella tiene una serie de características diferenciales.
El mecanismo fisiopatológico se resume en que el riñón hipoperfundido como consecuencia de la estenosis vascular renal estimula el sistema renina-angiotensina-aldosterona, que origina hipertensión arterial y alcalosis metabólica hipopotasémica.
El diagnóstico se establece basándose en unos criterios clínicos y analíticos que se resumen a continuación:
Criterios clínicos y analíticos sugerentes de hipertensión secundaria:
-
Inicio brusco de la HTA, sin antecedentes familiares, especialmente en mujeres <30 años o varones >60 años.
-
Lesión de órganos diana como retinopatía grado III-IV o hipertrofia ventricular izquierda.
-
Respuesta inadecuada al tratamiento habitual.
-
Evidencia de arteriosclerosis en múltiples territorios o nefropatía isquémica.
-
Empeoramiento renal o caída brusca de la TAS tras IECA/ARAII.
-
Hipopotasemia, soplos vasculares, asimetría renal, proteinuria no nefrótica, alcalosis hipocaliémica.
Exploraciones complementarias:
-
El eco-Doppler renal se utiliza como prueba inicial por su seguridad y bajo coste.
-
En caso de alta sospecha o resultados no concluyentes, se recurre a angiorresonancia o arteriografía, esta última como prueba definitiva aunque con riesgos asociados.
El tratamiento de la hipertensión renovascular busca proteger la función renal, frenar el avance del daño y controlar la presión arterial. Los IECA y ARA II son los fármacos de elección, salvo en casos de estenosis bilateral, riñón único con estenosis o insuficiencia renal aguda recurrente con su uso.
Aunque estas terapias ayudan a controlar la tensión, no evitan siempre la progresión de la enfermedad, por lo que se recomienda la revascularización del riñón isquémico cuando no hay contraindicaciones claras. Esta puede no ser necesaria si la estenosis es leve, no progresa el daño renal o la tensión está bien controlada.
La revascularización puede hacerse mediante angioplastia percutánea, con o sin stent, aunque hay un 35% de reestenosis en estenosis ateromatosas. La cirugía es más definitiva (96% de curación) y se indica tras el fracaso de la angioplastia, ante ateromatosis extensa, necesidad de cirugía aórtica conjunta o fibrodisplasia grave. Tras la intervención, muchos pacientes siguen requiriendo tratamiento antihipertensivo, pero en dosis más bajas.
Recordar: Se debe sospechar una HTA renovascular ante el empeoramiento brusco de un paciente hipertenso previamente bien controlado.
Hipertensión maligna
Se define como la emergencia hipertensiva en la que existe evidencia de daño vascular. Generalmente ocurre en varón en torno a los 40 años.
Anatomía patológica:
– Necrosis fibrinoide.
– Arterioloesclerosis hiperplásica (“en capas de cebolla”).
Clínica:
– Edema de papila o hemorragias/exudados retinianos
– Insuficiencia renal rápidamente progresiva.
– Encefalopatía hipertensiva.
– Descompensación cardiaca.
– Anemia hemolítica microangiopática.
– Hiperaldosteronismo hiperreninémico.
Hipertensión Sistólica Aislada
La hipertensión sistólica aislada (HTA) es una forma específica de hipertensión en la que solo la presión arterial sistólica —el valor más alto, que representa la presión en las arterias cuando el corazón se contrae— está elevada (por encima de 140 mmHg), mientras que la presión diastólica —el valor más bajo, que refleja la presión cuando el corazón está en reposo— permanece normal (por debajo de 90 mmHg).
Esta condición es más frecuente en personas mayores debido a la pérdida de elasticidad de las arterias, lo que provoca un aumento de la rigidez vascular y, en consecuencia, una elevación de la presión sistólica. A pesar de que por muchos años fue subestimada, hoy se reconoce que la hipertensión sistólica aislada es un importante factor de riesgo cardiovascular, especialmente en adultos mayores.
Se asocia con un mayor riesgo de infarto, accidente cerebrovascular, insuficiencia cardíaca y enfermedad renal crónica. Su tratamiento incluye cambios en el estilo de vida, como dieta y ejercicio, y el uso de fármacos antihipertensivos que ayudan a reducir la presión sistólica sin afectar en exceso la diastólica, protegiendo así al paciente de posibles efectos adversos.
Causas de hipertensión sistólica aislada:
La causa más frecuente de HTA es la idiopática (HTA esencial). La causa más frecuente de HTA secundaria son las enfermedades renales. La causa endocrina más frecuente de HTA es el uso de anticonceptivos orales.
Conclusión
El manejo de la hipertensión arterial requiere un enfoque integral basado en cambios en el estilo de vida y, en casos necesarios, tratamiento farmacológico. La OMS enfatiza la importancia de individualizar las estrategias terapéuticas según el riesgo cardiovascular y la edad del paciente.
Un control adecuado de la presión arterial reduce significativamente el riesgo de complicaciones cardiovasculares, mejorando la calidad de vida y la esperanza de vida de los pacientes hipertensos.
Información del Autor
Fuentes consultadas
- Adeva Alfonso J; Aledo Serrano A; 2019; MANUAL AMIR CARDIOLOGÍA Y CIRUGÍA CARDIOVASCULAR; 12.ª edición; Madrid.
Última actualización: 04/04/2025